
Kemi 2, uppdrag nr 1
Fråga 1
Magnesium reagerar med saltsyra under bildning av magnesium(II)joner och vätgas.
- Ställ upp reaktionsformeln. Om deltagande partikelslag är joner ska detta visas i reaktionsformeln.
- Hur ska man göra för att reaktionen ska gå så fort som möjligt?
———————————————
- Mg reagerar med HCl och bildar Mg2+ H2 samt Cl
I och med att kvävgas bildar en kovanelnt bindning för att uppnå ädelgasstruktur så krävs två saltsyramolekyler i reaktionsdelen.
Mg + 2HCl à Mg2+ + 2Cl– + H2(g)
2. Olika faktorer påverkar reaktionshastigheten mellan olika molekyler, joner och atomer. En avgörande faktor är sannolikhetsfaktorn för att de olika atomerna ska kollidera med varandra. I och med att kollideringen mellan olika molekyler är grundläggande för att en ny bindning mellan olika atomer ska bildas (vilket är vad som skapar nya ämnen) så kan frågan göras om till ”hur kan vi öka sannolikheten för att fler molekyler eller atomer ska kollidera med varandra. Från Kemi 1 lärde vi oss att temperatur är en vanlig faktor då molekyler och atomer rör sig mycket mer, exempelvis kokande vatten vilket då göra att hastigheten på de olika molekylerna eller atomerna är mycket högre samt sannolikheten att den träffar en annan och bildar en ny bindning ökar.
En annan faktor kan vara hur finfördelat ämnet i är i förhållande till reagenten. Har vi ett ämne vars substans är hög men fördelat på en mindre yta så är kontaktförhållandet mellan dessa två liten trots att den höga substansmängden. ”Snögubben smälter långsammare än övrig snö på marken” Så en önskvärd åtgärd ifall man vill skynda på reaktionshastigheten är att finfördela ämnet. Man kan även använda sig av en katalysator som skyndar på reaktionen utan att själv förbrukas. Egentligen så förbrukas den men återbildas i samma reaktion, exempelvis vid citronsyracyckeln.
Något som jag även gick in på ovan var substansmängden. Ju högre substansmängd desto högre sannolikhet att någon av dessa kolliderar med varandra. Andra faktorer är även omgivning som tryck.
Vad gäller frågan ovan så kan vi höja hastigheten på reaktionen genom att fördela magnesium samt öga substansmängden på saltsyran och öka temperaturen då Mg är i fast tillstånd har en mycket mer begränsas möjlighet till att röra sig.
Fråga 2
Vid 500oC reagerar syrgas och vätekloridgas med varandra och det bildas vattenånga och klorgas. Reaktionen leder till jämvikt.
- Skriv formeln för reaktionen.
- Teckna uttrycket för jämviktskonstanten K.
- Ange jämviktskonstantens enhet.
1) O2(g) + 4HCl (g) 2H2O (g) + 2Cl2
2) Enligt jämviktsekvationen så ska substansmängden av reaktanterna divideras men substansmängden för produkterna för att få den kvot som förklarar när molekyler som reagerar med varandra uppnår jämnviktsläge. Alltså när reaktionen går åt båda hållen i samma hastighet och koncentrationen av alla ämnen förblir densamma då de förbrukas och återbildas samtidigt.
Ett exempel på hur det ser ut är reaktionen ovan men för att få en bättre överblick kan det även tecknas:
aA + bB ↔ cC + dD.
För att då ta fram jämnviktskonstanten K så krävs en formel enligt nedan:
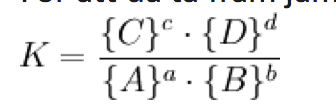
Genom detta samband så kan vi nu sätta upp ett samband och förhållande som gäller mellan substansmängden för de olika medverkande ämnena som uppfylls då jämnvikt råder.
K= (H2O2 * Cl22)/(O22 * HCl4)
3.
Likt alla ekvationer inom matematik så kan man alltid stryka lika tal vid division. Detta gäller även enheter vid beräkning av jämnviktskonstanten. En tydlig förklaring ser man i bilden nedan.

I vårt fall så blir alltså enheten (mol/dm3)-1
Fråga 3
Fosgen COCl2 kan framställas ur kolmonoxid och klor enligt formeln:
CO(g) + Cl2(g) COCl2(g)
En jämviktsblandning i en behållare med volymen 2,0 dm3 består av 4,0 mol CO, 2,0 mol Cl2 och 3,0 mol COCl2. Beräkna jämviktskonstanten.
————————————-
Enklast för att beräkna detta är att på ett strukturerat sätt rada upp den DATA vi har.
DATA
Volym: 2,0 dm3
Molmassa CO: 4,0 mol
Molmassa Cl2: 2,0 mol
Molmassa COCl2: 3,0 mol
För att då ta fram jämnviktskonstanten K så krävs en formel enligt nedan:
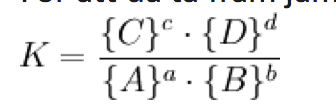
I och med att volymen är 2,0 så dividerar jag antalet mol samt volymen med 2 för att få det i ett förhållande mol/dm3
(1,5mol/dm3)/(2mol/dm3)*(1mol/dm3)=0,75
Svar: K=0,75
Fråga 4
Jämvikten 2SO2(g) + O2(g) ↔ 2SO3(g) har ställt in sig i ett slutet kärl. Reaktionen från vänster till höger är exoterm. Hur ska man ändra:
- temperaturen
- volymen
- substansmängden O2
om man vill öka substansmängden SO3 i blandningen?
————————————————————-
1. Genom att sänka temperaturen så kommer den exoterma reaktionen per automatik att gynnas.
2.
Vi nämnde i fråga 1 olika faktorer som bidrar till att reaktion ska gå ett visst håll. Genom att reglera på volymen så kommer trycket i behåller per automatik att öka. Vi får bäst avkastning av reaktionen i VL till HL genom att sänka på volymen och öka trycket.
3.
Genom att öka koncentration av exempelvis syre i vår reaktion så får vi inte per automatik en ökad substansmängd av SO Jag funderade länge över just varför substansmängden av syre i reaktionen ökar substansmängden av SO3 då jag vet att formeln ovan är balanserad och ökar vi substansmängden syre så finns det inte tillräckligt med svaveloxid i VL att reagera med. Dock så ökar sannolikheten att all svaveloxid reagerar om vi ökar substansmängden syre. I och med detta så kommer inte all syre i VL att förbrukas då vi saknar tillräckligt med svaveloxid men substansmängden av svaveltrioxid kommer sannolikt att öka.
Fråga 5
Man blandar 0,8 mol etanol med 0,5 mol ättiksyra. Sedan jämvikt ställt in sig finner man att det bildats 0,4 mol etylacetat och 0,4 mol vatten. Beräkna jämviktskonstanten för reaktionen.
etanol + ättiksyra ↔ etylacetat + vatten
—————————————————
Reaktionsformel:
C2H5OH + CH3COOH ↔ CH₃COOC₂H₅ + H2O
DATA:
nEtanol: 0,8 mol
nÄttiksyra: 0,5 mol
nEtylacetat: 0,4 mol
nVatten: 0,4 mol
Formler:
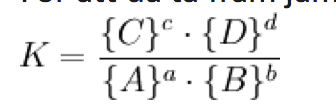
Uträkning:
Genom att ställa upp reaktionsformeln före och efter reaktion kan man få en god överblick över de substansmängderna som är med och deltar samt i vilka skeden.
Före reaktion:
etanol + ättiksyra ↔ etylacetat + vatten
0,8 mol 0,5 mol
Efter reaktion
etanol + ättiksyra ↔ etylacetat + vatten
0,4 mol 0,4 mol
Vid jämnvikt blir det:
0,8-0,4=0,4
0,5-0,4=0,1
Substansmängd etanol är 0,4 mol samt substansmängd för ättiksyra är 0,1 mol
Genom jämnviktsekvationen kan jag nu ta ut jämnviktskonstanten.
0,4*0,4/0,4*0,1=4
Svar: K=4
Fråga 6
I en behållare med volymen 50,0 dm3 införs 1,00 mol kolmonoxid och 3,40 mol vätgas. Gasblandningen upphettas till 630 K. Ämnena reagerar enligt formeln:
CO(g) + 2H2(g) ↔ CH3OH(g)
När jämvikt ställt in sig finner man att gasblandningen innehåller 0,40 mol metanol CH3OH. Beräkna jämviktskonstanten.
———————————————————_
Likt tidigare uppgifter kommer jag att använda mig av jämnviktsekvationen för att få ut konstanten som ska råda för att reaktionen ska gå i samma hastighet åt båda håll.
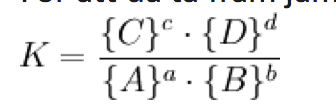
Det vi inledningsvis vet är:
Kolmonoxid: 1 mol
Vätgas: 3,4 mol
Metanol: 0,40 mol
Behållare volym: 50 dm3
I och med att vi vet att metanolen efter att jämnvikt är uppnådd ligger på 0,4 mol så kan vi även beräkna antalet mol på VL efter att jämnvikt är uppnådd.
Kolmonoxid: 1-0,4=0,6 mol
Vätgas=3,4-0,4-0,4=2,6 mol
I och med att jag har korrekt DATA för att kunna avgöra jämnviktskonstanten med jämnviktsekvationen så placerar jag in dessa i ekvationen likt ovan. Jag beaktar även direkt i denna ekvation behållarens volym för att få det per 1 kubikdecimeter.
(0,4 mol/50dm3) / (2,6 mol/50dm3)2 * (0,6mol/50dm3) = (246,54 mol/dm3)-2
Vi får fram enheten genom att konstatera vilka enheter som är ”delaktiga” i ekvationen. I och med att 2 vätemolekyler deltar i reaktionen och befinner sig i nämnaren så får vi mol/dm3)-2 då alla andra enheter slår ut varandra.
Fråga 7
Kväveoxid från bilgaser är ett miljöproblem. Vid förbränningstemperaturen ca 2300 K bildas NO enligt formeln:
N2(g) + O2(g) ↔ 2NO(g)
Jämviktskonstanten är 6,0·10-2 vid den angivna temperaturen. I en viss motor är cylindervolymen 0,50 dm3. Efter en förbränning innehåller cylindern 2,0·10-2 mol N2 och 1,0·10-5 mol O2 i jämvikt med en viss mängd NO. Beräkna mängden NO vid jämvikt.
——————————————————————–
Återigen är det nog smartast att strukturera upp den DATAn som är given via frågan för att kunna konstatera vad som behövs för att ha möjlighet att ta fram mängden NO vid jämnvikt.
DATA:
K=6,0·10-2
Syrgas: 1,0·10-5 mol
Vätgas: 2,0·10-2 mol
Kväveoxid: X2
Formler:
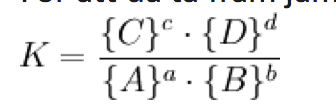
Uträkning:
Enklast för mig att räkna ut denna var att få en god överblick över själva reaktionerna och antalet mol som deltar genom att ställa upp reaktionsformeln och markera ut mol som deltar efter förbränning.
2,0·10-2 +1,0·10-5 ↔ X2
N2(g) + O2(g) ↔ 2NO(g)
Skulle vi placera in den DATA vi har i jämviktsekvationen skulle det bli, OBS att jag fördubblar antalet mol för att få det /dm3:
(X*2/dm3)2/(2,0·10-2*2/dm3)*(1,0·10-5*2/dm3)= 6,0·10-2 §
Ekvationen blir följande för att få ut ett värde på X2
(2,0·10-2mol/0,5dm3)*(1,0·10-5mol/0,5dm3)* 6,0·10-2= 4,8*10-8
I och med att svaret är mängden kväveoxid2 så behöver vi ta roten ur det resultatet för att få den korrekta mängden.
Svar: 2,19*10-4 mol/dm3
Fråga 8
För jämvikten CO(g) + H2O(g) CO2(g) + H2(g) är jämviktskonstanten 0,36 vid 2000 K. Man blandar 1,00 mol av vardera CO, H2O, CO2 och H2 i ett reaktionskärl med volymen 3,00 dm3. Blandningen upphettas till 2000 K.
- Råder jämvikt i den givna blandningen? Om inte åt vilket håll går reaktionen?
- Hur stor substansmängd kommer att finnas av de olika ämnena när jämvikt ställt in sig?
———————————————————————————–
- Snabbt kan vi konstatera att ingen jämvikt råder då (1/3*1/3)/ (1/3*1/3)=1. Reaktionen kommer att gå åt vänster.
- För att enklast beräkna ut detta kommer jag att använda mig av bokstäver för substansmängden tillhörande de olika ämnena.
CO(g) + H2O(g) ↔ CO2(g) + H2
I och med att reaktionen går åt vänster och den ursprungliga substansmängden 1 mol är känd så kan vi via en ekvation och den angivna jämnviktskonstanet avgöra substansmängden när jämnvikt råder.
Ekvationen säger oss att
(CO2-X/3dm3)2*(H2-X/3dm3*)/(CO+X/3dm3)2*(H2O+X/3dm3*)=0,36
(1-x/3,00)2/(1+x/3)2=0,36
Vi löser då ut X och får det till 0,25
Substansmängderna blir då följande
CO2: 0,75 mol
H2: 0,75 mol
CO: 1,25 mol
H2O: 1,25 mol

Hej Joe!
Tack så jättemycket för din hjälp under flertal av mina studier hos Hermods!
Undrar om du har möjlighet att publicera resterande uppdrag av kemi 2?
Tack på förhand!
Med vänlig hälsning
Hermods student i nöd
GillaGilla
Hej,
Ska försöka göra det nu direkt, beklagar att det tagit lite tid.
Hälsningar
Joe
GillaGilla
Tack för uppdragen!
Jag skulle vilja fråga dig om du kan dela med dig av laborationerna som gjordes under kursens gång? Vidare skulle det vara mycket tacksamt om du kunde berätta lite om hur den muntliga examinationen gick till (vilken lärare hade du) och hur svår kursen var generellt? Använde du dig mest av den rekommenderade kurslitteraturen eller också Youtube? Har du några allmänna rekommendationer inför Kemi 2 kursen?
GillaGilla
Hej Joe,
Har du möjlighet att ladda upp labbarna för kemi 2?
Tack på förhand
GillaGilla
Hej vill tacka för en grym sida!
Jag undrar också om du har laborationerna för kemi 2? Skall läsa kursen i höst men försöker arbeta med uppdragen under sommaren för att inte slösa någon tid.
hälsningar
Frida
GillaGilla
Tack för att du underlättar studierna för oss som pluggar hos Hermods. Tänkte höra om du har lust att publicera laborationerna i Kemi 2?
GillaGilla